肌肽纳米脂质体改善人成纤维细胞抗氧化性能研究
未知 - Best Carrier 2022-12-02
肌肽纳米脂质体改善人成纤维细胞抗氧化性能研究
罗丹1,洪延涵2,梁明3,尹西拳3,闻庆2,刘卫1,4#
(1. 华中科技大学生命科学与技术学院,武汉 430074;2. 武汉百思凯瑞生物科技有限公司,武汉 430075;3. 无限极(中国)有限公司,广州 510665;4. 华中科技大学国家纳米药物工程技术研究中心,武汉 430075)
摘要:采用高压匀质技术制备肌肽纳米脂质体,平均粒径为65.5 nm,PDI(多分散性系数)为0.290,Zeta电位为-43.6 mV,载药量和包封率分别为6.6%和67.0 %。采用Franz扩散池法考察其体外透皮性能,结果显示,其12 h体外皮肤累积透过量为114.32 μg /cm2,皮肤滞留量为 16.08 μg /cm2。相同肌肽质量分数的纳米脂质体霜剂与普通霜剂相比,皮肤滞留量显著性增加。研究了游离肌肽和肌肽纳米脂质体分别对H2O2诱导人成纤维细胞(HSF)细胞氧化损伤的保护作用,测定HSF细胞中MDA含量、SOD和CAT活性的变化。结果显示,肌肽质量浓度为25~400 mg/L时,与游离肌肽组相比,肌肽纳米脂质体使受损HSF细胞活力显著上升(P<0.05);肌肽质量浓度为200 mg/L时,肌肽纳米脂质体使HSF细胞中MDA含量显著减少(P<0.05),SOD和CAT活力显著上升(P<0.05)。表明肌肽纳米脂质体的抗氧化性能明显优于游离肌肽。(1. 华中科技大学生命科学与技术学院,武汉 430074;2. 武汉百思凯瑞生物科技有限公司,武汉 430075;3. 无限极(中国)有限公司,广州 510665;4. 华中科技大学国家纳米药物工程技术研究中心,武汉 430075)
关键词:肌肽;纳米脂质体;皮肤滞留;人成纤维细胞;抗氧化性能
Study on the improvement of oxidation resistance of human fibroblasts by carnosine nanoliposome
Abstract:: Carnosine nanoliposome was prepared by high pressure homogenization technique. Properties of the product were measured as particle size, 65.5 nm; PDI, 0.290; Zeta potential , -43.6 mV; rate of drug loading, 6.60 % ; rate of encapsulation, 77.0 % .The in vitro skin permeation and retention tests were performed with Franz diffusion cell method. Results showed that the cumulative permeation and skin retention in 12 h was 114.32 and 16.08 μg/cm2, respectively. The skin retention of carnosine nanoliposome cream product was significantly higher than that of conventional carnosine cream product in the same fraction. To investigate the protective effects of carnosine nanoliposome and carnosine solution on oxidative injury in HSF cells induced by H2O2, the activities of malondialdehyde (MDA), superoxide dismutase (SOD), catalase (CAT) and the viability of HSF cells were determined. Results showed that compared with the free carnosine solution , the cell activity of carnosine nanoliposomes increased significantly (P<0.05) within the scope of the concentration of 25~400 mg/L; the content of MDA in HSF cells decreased significantly (P<0.05), while the activities of SOD and CAT increased significantly (P<0.05) at the concentration of 200 mg/L. This research indicated that the antioxidant ability of carnosine nanoliposomes was obviously better than that of free carnosine solution.
Keywords: carnosine; nanometer liposome; skin retention; HSF cell, oxidation resistance
肌肽是近年来被广泛研究的一类天然活性肽,具有抗氧化、增强免疫、舒张血管和促进细胞能量代谢等作用[1]。同时肌肽可以改善细胞的正常功能,使衰老细胞年轻化[2],因此被广泛应用在抗衰类护肤化妆品中。纳米脂质体是一类能把活性成份包封于类脂质双分子层内而形成的微型泡囊体,具有良好的靶向性、缓释性、无刺激性和易降解等优点[3,4]。研究表明,纳米脂质体可显著提高护肤活性成分的稳定性,促进护肤活性成分的透皮吸收[5,6],显著改善其护肤功效。本文采用高压匀质技术制备肌肽纳米脂质体,并对其理化性能和稳定性进行研究,比较了游离肌肽和肌肽纳米脂质体的体外透皮性能和抗氧化性能,研究结果为肌肽纳米脂质体应用于抗衰化妆品提供实验依据。
1 材料与方法
1.1 主要试剂与仪器
肌肽,南京莱昂生物科技有限公司;大豆卵磷脂,北京美亚斯磷脂有限公司; 胆固醇,分析纯,国药集团化学试剂有限公司;甘油、丙二醇,阿拉丁试剂;人成纤维细胞(HSF),昆明细胞库;0.25%胰酶-EDTA,DMEM(高糖型)液体培养基,胎牛血清(FBS),Gibco公司;H2O2溶液,阿拉丁试剂有限公司;细胞活力检测试剂盒(CCK-8),日本Dojindo公司;BCA蛋白定量试剂盒,碧云天生物技术公司;SOD测定试剂盒、CAT测定试剂盒、MDA测定试剂盒,南京建成生物科技有限公司;SPF级SD雄性大鼠(体重 200~220 g),购自于湖北省实验动物研究中心(实验动物生产许可证号:SCXK(鄂)2015-0018)。
JN-02HC高压纳米均质机,广州聚能生物科技有限公司;Zetasizer/Nano-ZS90 纳米电位粒径分析仪,英国Malvern公司;Tecnai G220透射电子显微镜,荷兰FEI公司;Agilent 1260高效液相色谱仪(HPLC),美国安捷伦公司;TK-12D 透皮扩散仪,上海锴凯科技贸易有限公司;超净工作台,苏州苏洁净化设备有限公司;赛默飞世尔二氧化碳培养箱,上海旦鼎国际贸易有限公司;多标记分析仪,Victor多标记分析仪,珀金埃尔默企业管理(上海)有限公司。
1.2 实验方法
1.2.1 肌肽纳米脂质体的制备
称取处方量磷脂、胆固醇于适量乙醇中,65 ℃下恒温水浴溶解后降温至45 ℃,磁力搅拌15 min后依次匀速加入等温的处方量丙二醇、甘油、肌肽和水,边加边搅拌,快速混匀后即得初乳。将初乳于剪切机中剪切10 min后得到微米级分散体,再于高压均质机中进行120 MPa、3次循环的均质处理,即得肌肽纳米脂质体。
1.2.2 肌肽纳米脂质体的理化性质表征
1)粒径与Zeta电位。取适量的肌肽纳米脂质体,用超纯水稀释一定倍数,使样液的Mean Count Rate(平均光强)为150~300。用纳米电位粒径分析仪测定其粒径、PDI和Zeta电位,粒径测定角度为 90°,测试温度为 25 ℃。
2)载药量与包封率。HPLC分析方法:选用Sepax HP-Amino色谱柱,以乙腈∶30 mmol/L磷酸氢二钾水溶液(磷酸调pH至6.8)= 65∶35为流动相进行分析,在波长为214 nm处能检测出肌肽,柱温:30℃,流速:1 mL/min,进样量:10 μL。
用超滤离心法分离纳米脂质体和游离肌肽[7]。精确移取制备好的肌肽纳米脂质体0.5 mL,置于超滤离心管(截流相对分子质量为3 KD)中,经12000 r/min离心30 min,收集滤液用HPLC测得其中游离肌肽的含量,按下列公式计算包封率和载药量。
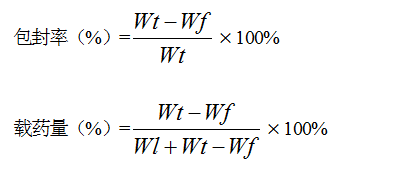
式中,Wt为投药量,Wf为游离肌肽含量,Wl为膜材含量。
3)微观形貌。取肌肽纳米脂质体以超纯水稀释适当倍数,取1滴置于覆有Formvar膜的铜网上,自然干燥后,滴加一滴2%磷钨酸溶液负染1~2 min,用滤纸吸干多余液体,晾干后置透射电子显微镜下观察其微观形态。
1.2.3 肌肽纳米脂质体的稳定性
将制备的肌肽纳米脂质体置于常温、4℃、45℃和光照条件下存放,分别于30 d、60 d、90 d取出测定并考察其粒径、PDI和Zeta电位的变化情况。
1.2.4 体外透皮性能测试
取一定量的肌肽原料药和肌肽纳米脂质体分别加入到空白膏霜中,搅拌混匀,得到相同肌肽质量分数的原料药霜剂和纳米脂质体霜剂。参照文献[8],采用垂直式Franz扩散池法进行离体鼠皮的透皮实验,将完整无破损的大鼠腹部皮肤固定于接收池和供给池之间,取上述肌肽原料药普通霜剂和肌肽纳米脂质体霜剂各1 g于供给室中,以含有质量分数为20%丙二醇的生理盐水为接受液,37℃下300 r/min搅拌。于1 h、2 h、4 h、6 h、8 h、10 h、12 h吸取接收液0.5 mL,并补充等温空白接受液0.5 mL,HPLC检测,计算各时间点的药物累积透过量。公式如:
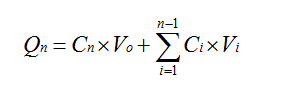
式中,Qn为药物累计透过量,Cn为第n次测得的药物浓度,Ci 为第i个点所测得的药物浓度,V0为扩散池的体积即加入释放介质的量,Vi 为每次取样的量。单位面积累计渗透量 Q = Qn / S,其中S为扩散池的面积 3.14 cm2。
透皮实验结束后,取下皮肤,用超纯水洗去样品残液后剪碎,转入组织匀浆器中充分研磨成匀浆液,加适量接受液转移至离心管中,7000 r/min 离心20 min,取上清液,用0.45 μm滤膜过滤后,HPLC分析,计算皮肤中肌肽的滞留量。
1.2.5 抗氧化功效评价
1)肌肽纳米脂质体对HSF细胞增殖的影响。采用CCK-8法测底HSF细胞的活力[9],将HSF细胞用1 mL 0.25%的胰蛋白酶溶液消化3 min后,加入DMEM完全培养基终止消化,1000 r/min,离心5 min,弃上清,加入DMEM完全培养基重悬细胞,再将HSF细胞接种于96孔板,细胞密度为6×103个/孔,待HSF细胞贴壁后,对照组加培养基,给药组加入100 μL含有游离肌肽和肌肽纳米脂质体的培养液,稀释至肌肽的终质量浓度分别为25、50、100、200、400 mg /L,培养24 h后每孔加入CCK-8试剂10 μL,于37 ℃、5% CO2条件下培养2 h,在450 nm波长下测OD值,测定HSF细胞活力。
2)肌肽纳米脂质体对H2O2诱导HSF细胞氧化损伤的影响[10]。将HSF细胞接种于96孔板,细胞密度为6×103个/孔,培养24 h后,对照组加培养基,模型组加入浓度为0.8 mmol/L的H2O2,给药组加入浓度为0.8 mmol/L的H2O2同时加入肌肽的终质量浓度分别为25、50、100、200、400mg/L的游离肌肽和肌肽纳米脂质体共培养,于37 ℃、5% CO2条件下培养24 h后用CCK-8法测定HSF细胞活力。
3)MDA、SOD、CAT生化指标的测定。将HSF细胞接种于6孔板,细胞密度为3×105个/孔,培养24 h后,对照组加培养基,模型组加入浓度为0.8 mmol/L的H2O2,给药组加入浓度为0.8 mmol/L的H2O2同时加入肌肽的终质量浓度分别为50 mg/L和200 mg/L的游离肌肽和肌肽纳米脂质体共培养,培养24 h后收集细胞,加入500 μL蛋白裂解液[11],反复冻融3次,将细胞裂解,12000 r/min离心 5 min 后收集裂解产物备用,采用BCA法测定蛋白浓度。分别采用细胞丙二醛(MDA)测试盒、SOD 活性检测试剂盒和CAT检测试剂盒检测细胞内MDA含量,SOD和CAT酶活力水平,具体操作步骤按照试剂盒操作说明进行。
1.2.6 数据统计与分析
数据结果采用SPSS 20.0软件进行统计学处理,所有数据均采用x±s表示,不同肌肽纳米脂质体浓度处理间的差异采用one-way ANOVA进行比较分析,以P<0.05为差异显著,最终处理结果用origin 8.0作图。
2 结果与讨论
2.1 理化性质
肌肽纳米脂质体为黄色透明澄清液体,测得其粒径为65.5 nm,PDI为0.290,Zeta电位为-43.6 mV,测得其中肌肽的包封率为67.0%,载药量为6.6%。肌肽纳米脂质体粒径分布如图1所示。
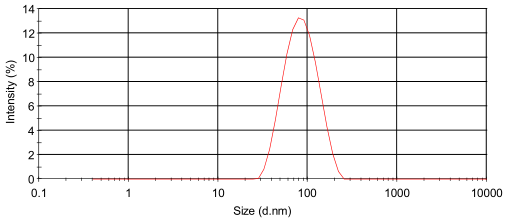
图1 肌肽纳米脂质体粒径分布图
利用透射电子显微镜观察得到肌肽纳米脂质体的微观形貌,如图2所示。

图2 肌肽纳米脂质体透射电镜图
肌肽纳米脂质体在透射电镜下基本呈圆形,未见脂质体集聚现象,平均粒径为60~70 nm,粒径比较均匀。放大其中一个脂质体观察其微观结构可以看到:药物溶液仅仅被一层类脂双分子层膜包裹,为典型的单室脂质体。该种脂质体有效体积小,比多室脂质体和大的多孔脂质体更容易释放有效包封物,并且能渗透到角质层或更深的皮层[12]。
2.2 稳定性
稳定性实验结果见表1。
2.2 稳定性
稳定性实验结果见表1。
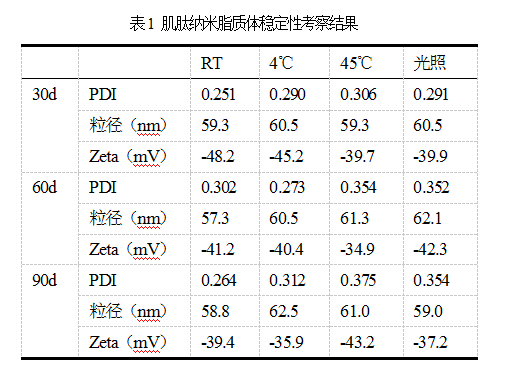
在四个条件下考察90 d发现,制备得到的肌肽纳米脂质体粒径变化、Zeta电位变化不大。置于45℃、光照保存的载体PDI变大,说明该条件下储存载体有团聚的倾向,可能是贮存温度过高,导致脂质膜流动性增加,脂质体稳定性降低。故最佳贮藏环境为避光、4℃保存。
2.3 体外透皮性能
肌肽普通霜剂及纳米脂质体霜剂12 h皮肤累积透过量及皮肤滞留量的测定结果如图3所示。
2.3 体外透皮性能
肌肽普通霜剂及纳米脂质体霜剂12 h皮肤累积透过量及皮肤滞留量的测定结果如图3所示。
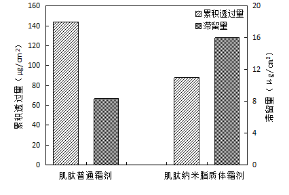
图3 药物体外皮肤累积透过量及滞留量
由图3分析可知,肌肽普通霜剂的皮肤累积透过量为144.83 μg/cm2,皮肤滞留量为8.44 μg/cm2;肌肽纳米脂质体霜剂的皮肤累积透过量为92.32 μg/cm2,皮肤滞留量为16.08 μg/cm2。肌肽普通霜剂中肌肽的皮肤累积透过量大于肌肽纳米脂质体霜剂中肌肽的皮肤累积透过量,滞留量小于肌肽纳米脂质体霜剂中肌肽的皮肤滞留量。
该结果表明,肌肽纳米脂质体皮肤透过量更小,能够将高浓度的肌肽缓慢释放,避免渗透量过高导致的活性物质流失,且纳米脂质体滞留量更高,能够有效促进肌肽在皮肤中的高浓度滞留,提高其生物利用率。
2.4 体外抗氧化研究
2.4.1 肌肽纳米脂质体对HSF细胞增殖的影响
不同质量浓度的游离肌肽和肌肽纳米脂质体处理HSF细胞24 h后,细胞活力变化如图4所示。
该结果表明,肌肽纳米脂质体皮肤透过量更小,能够将高浓度的肌肽缓慢释放,避免渗透量过高导致的活性物质流失,且纳米脂质体滞留量更高,能够有效促进肌肽在皮肤中的高浓度滞留,提高其生物利用率。
2.4 体外抗氧化研究
2.4.1 肌肽纳米脂质体对HSF细胞增殖的影响
不同质量浓度的游离肌肽和肌肽纳米脂质体处理HSF细胞24 h后,细胞活力变化如图4所示。
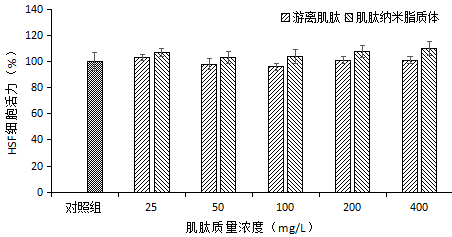
图4 不同质量浓度的游离肌肽和肌肽纳米脂质体对HSF细胞增殖的影响
游离肌肽和肌肽纳米脂质体添加量在25~400 mg/L范围之间时,与对照组比较,HSF细胞的存活率在90~110%之间,说明游离肌肽和肌肽纳米脂质体对HSF细胞的细胞活力无显著影响。由图4分析可知,游离肌肽和肌肽纳米脂质体添加量在25~400 mg/L范围之间时,与对照组比较,HSF细胞的存活率在90~110%之间,说明游离肌肽和肌肽纳米脂质体对HSF细胞的细胞活力无显著影响。
2.4.2 肌肽纳米脂质体对H2O2诱导HSF细胞活力的影响
不同质量浓度游离肌肽和肌肽纳米脂质体对H2O2诱导的HSF细胞活力影响如图5所示。
2.4.2 肌肽纳米脂质体对H2O2诱导HSF细胞活力的影响
不同质量浓度游离肌肽和肌肽纳米脂质体对H2O2诱导的HSF细胞活力影响如图5所示。
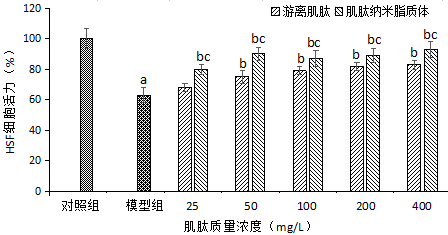
图5 不同质量浓度的游离肌肽和肌肽纳米脂质体对H2O2诱导HSF细胞活力的影响
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与游离肌肽比较,cP<0.05。
由图5分析可知,模型组HSF细胞经0.8 mmol/L的H2O2诱导后,细胞活力降低,下降为63.97%,加入浓度为25~400 mg/L的肌肽纳米脂质体后,HSF细胞活力上升,且具有显著性(P<0.05)。与游离肌肽组相比,肌肽纳米脂质体的细胞活力上升,且具有显著性(P<0.05)。
2.4.3 MDA、SOD、CAT生化指标的变化
MDA可引起脂质过氧化作用,进而形成过氧化物,其含量的多少直接影响机体内脂质过氧化程度,从而间接反映细胞损伤的程度[13]。游离肌肽和肌肽纳米脂质体对H2O2诱导HSF细胞中MDA含量的影响如图6所示。
2.4.3 MDA、SOD、CAT生化指标的变化
MDA可引起脂质过氧化作用,进而形成过氧化物,其含量的多少直接影响机体内脂质过氧化程度,从而间接反映细胞损伤的程度[13]。游离肌肽和肌肽纳米脂质体对H2O2诱导HSF细胞中MDA含量的影响如图6所示。
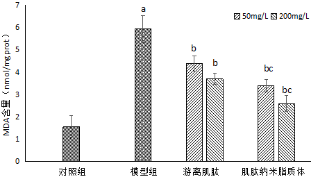
图6 游离肌肽和肌肽纳米脂质体对H2O2诱导HSF细胞中MDA含量的影响
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与游离肌肽比较,cP<0.05。
由图6可以看出,与对照组比较,模型组HSF细胞经0.8 mmol/L的H2O2诱导后,MDA含量从对照组的1.86 nmol/mgprot上升至5.93 nmol/mgprot,表明添加H2O2诱导细胞发生氧化损伤,使细胞中MDA含量显著增高升高(P<0.05)。与模型组比较,加入不同浓度的游离肌肽和肌肽纳米脂质体均可不同程度抑制MDA含量,且具有显著性差异(P<0.05)。当肌肽质量浓度为50 mg/L和200 mg/L时,与游离肌肽组相比,肌肽纳米脂质体的MDA含量减少,且具有显著性(P<0.05),表明肌肽纳米脂质体对抗脂质过氧化的作用优于游离肌肽。
超氧化物歧化酶(SOD)是一种源于生命体的活性物质,能消除生物体在新陈代谢过程中产生的有害物质,可对抗与阻断因氧自由基对细胞造成的损害,并及时修复受损细胞,在细胞抗氧化系统中[14]。过氧化氢酶(CAT)是过氧化物酶体的标志酶,是催化过氧化氢分解成氧和水的酶,存在于细胞的过氧化物体内。SOD和CAT是细胞中直接的内源性抗氧化剂[15]。本文研究了肌肽纳米脂质体在氧化应激条件下对细胞内抗氧化酶的影响。不同质量浓度的肌肽纳米脂质体作用于H2O2诱导的HSF细胞后,细胞内SOD和CAT活力的影响如图7~8所示。
超氧化物歧化酶(SOD)是一种源于生命体的活性物质,能消除生物体在新陈代谢过程中产生的有害物质,可对抗与阻断因氧自由基对细胞造成的损害,并及时修复受损细胞,在细胞抗氧化系统中[14]。过氧化氢酶(CAT)是过氧化物酶体的标志酶,是催化过氧化氢分解成氧和水的酶,存在于细胞的过氧化物体内。SOD和CAT是细胞中直接的内源性抗氧化剂[15]。本文研究了肌肽纳米脂质体在氧化应激条件下对细胞内抗氧化酶的影响。不同质量浓度的肌肽纳米脂质体作用于H2O2诱导的HSF细胞后,细胞内SOD和CAT活力的影响如图7~8所示。
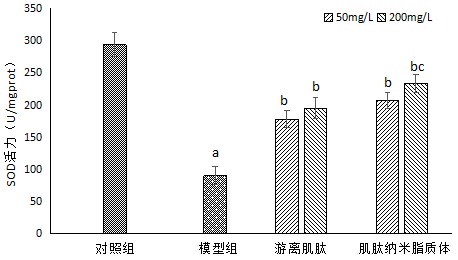
图7 游离肌肽和肌肽纳米脂质体对H2O2诱导HSF细胞中SOD活力的影响
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与游离肌肽比较,cP<0.05。
由图7可以看出,与对照组相比,用0.8 mmol/L H2O2诱导HSF细胞后,模型组HSF细胞内SOD活力由294.01 U/mgprot降低到90.73 U/mgprot,具有显著性差异(P<0.05);与模型组比较,不同质量浓度游离肌肽和肌肽纳米脂质体处理后均明显提高细胞裂解液中SOD活力,且具有显著性差异(P<0.05),当肌肽质量浓度为50 mg/L时,与游离肌肽组相比,肌肽纳米脂质体的SOD活力上升,且具有显著性差异(P<0.05),表明肌肽纳米脂质体提高SOD酶活的能力优于游离肌肽,更大程度降低H2O2诱导的氧化应激的伤害。
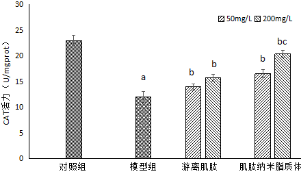
图8 游离肌肽和肌肽纳米脂质体对H2O2诱导HSF细胞中CAT活力的影响
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与游离肌肽比较,cP<0.05。
由图8可以看出,与对照组相比,用0.8 mmol/L H2O2诱导HSF细胞,模型组HSF细胞内CAT活力由23.68 U/mgprot降低到11.49 U/mgprot,具有显著性差异(P<0.05);与模型组比较,不同质量浓度游离肌肽和肌肽纳米脂质体处理后均明显提高细胞裂解液中CAT活力,且具有显著性差异(P<0.05),当肌肌肽质量浓度为200 mg/L时,与游离肌肽组相比,肌肽纳米脂质体的CAT活力上升,且具有显著性差异(P<0.05),表明肌肽纳米脂质体提高CAT酶活的能力优于游离肌肽。
3 结论
本实验所制备的肌肽纳米脂质体为球形或椭圆形颗粒,包封率为67.0%,平均粒径为65.5 nm,Zeta电位为-43.6 mV,避光低温下储存稳定性良好。纳米脂质体能改善肌肽的透皮吸收性能,显著增强其皮肤靶向滞留能力,且相对于游离肌肽,具有更好的细胞抗氧化性能。因此,肌肽纳米脂质体在抗衰护肤化妆品中具有良好的应用前景。
参考文献
3 结论
本实验所制备的肌肽纳米脂质体为球形或椭圆形颗粒,包封率为67.0%,平均粒径为65.5 nm,Zeta电位为-43.6 mV,避光低温下储存稳定性良好。纳米脂质体能改善肌肽的透皮吸收性能,显著增强其皮肤靶向滞留能力,且相对于游离肌肽,具有更好的细胞抗氧化性能。因此,肌肽纳米脂质体在抗衰护肤化妆品中具有良好的应用前景。
参考文献
[1] 臧国雄, 王辉, 许素华,等. 肌肽及其生理活性研究进展[J]. 食品科学, 2009, 30 (09): 273 - 275.
[2] McFarland G. A., Holliday R.. Further evidence for the rejuvenating effects of the dipeptide L-carnosine on cultured human diploid fibroblasts [J]. Experimental Gerontology , 1999 , 34 : 35 - 45 .
[3] 谭旭坤, 余倩, 柯永乐, 等. 聚乙二醇修饰的原花青素脂质体的制备及稳定性研究[J]. 现代化工, 2016, 36(7): 64 - 67.
[4] 杨鹏波, 张华. 脂质体的研究新进展[J]. 浙江中医药大学学报, 2013, 37 (7): 936 - 939.
[5] 李霞, 田仁德, 许琦, 等. 神经酰胺ⅢB纳米脂质体的制备及功效评价[J]. 日用化学工业, 2016, 46 (9): 514 - 518.
[6] 罗绍强, 唐青涛, 吴志韻. 纳米透皮技术在化妆品中的应用[J]. 日用化学品科学, 2011, 34 (09) : 22 - 26 .
[7] 郑媛, 纪晓峰, 郑兰红, 等. 扇贝多肽脂质体制备工艺的优化与表征[J]. 食品工业科技, 2013, 34 (24) : 309 - 313.
[8] DRAGICEVIC - CURICN, GRAEFE S, GITTER B,et al. Surface charged temoporfin -loaded flexible vesicles: in vitro skin penetration studies and stability [J]. International Journal of Pharmaceutics, 2010, 384 (1) : 100 - 106.
[9] 徐锦荣, 丛斌, 李淑瑾, 等. CCK-8对TNF-α诱导大鼠RSC-364细胞MMPs/TIMP-1的影响[J]. 中国药理学通报, 2017, 33 (04) : 567-571.
[10] 宋菲, 王挥, 唐敏敏, 等. 天然椰子油提取物对H2O2诱导的HSF细胞氧化损伤的保护作用[J]. 日用化学工业, 2017, 47 (09) : 517-521.
[11] Song F, Zhang L, Yu H X, et al. The mechanism underlying proliferation-inhibitory and apoptosis-inducing effects of curcumin on papillary thyroid cancer cells[J]. Food Chemistory, 2012, 132 (1) : 43 -50.
[12] 赵华, 董银卯, 何聪芬, 等. 维生素C脂质体的制备与研究[J]. 香料香精化妆品, 2006, 6 (3): 17 - 20.
[13] 罗毅, 李瑞金, 孙永强, 等. 椰子油和大豆油的乙氧基化物对小鼠肝脏的脂质过氧化效应研究[J]. 日用化学工业, 2012, 42 (02) : 101-103+128.
[14] 戴玥, 余晓斌. 抗氧化菌的筛选及混菌发酵红景天条件优化[J]. 日用化学工业, 2017, 47 (07) : 408 - 413.
[15] 邵茜, 付雪媛, 徐慧, 等. 不同来源胶原肽对光老化皮肤成纤维细胞的影响研究[J]. 日用化学品科学, 2017, 40 (05) : 26 - 29.

